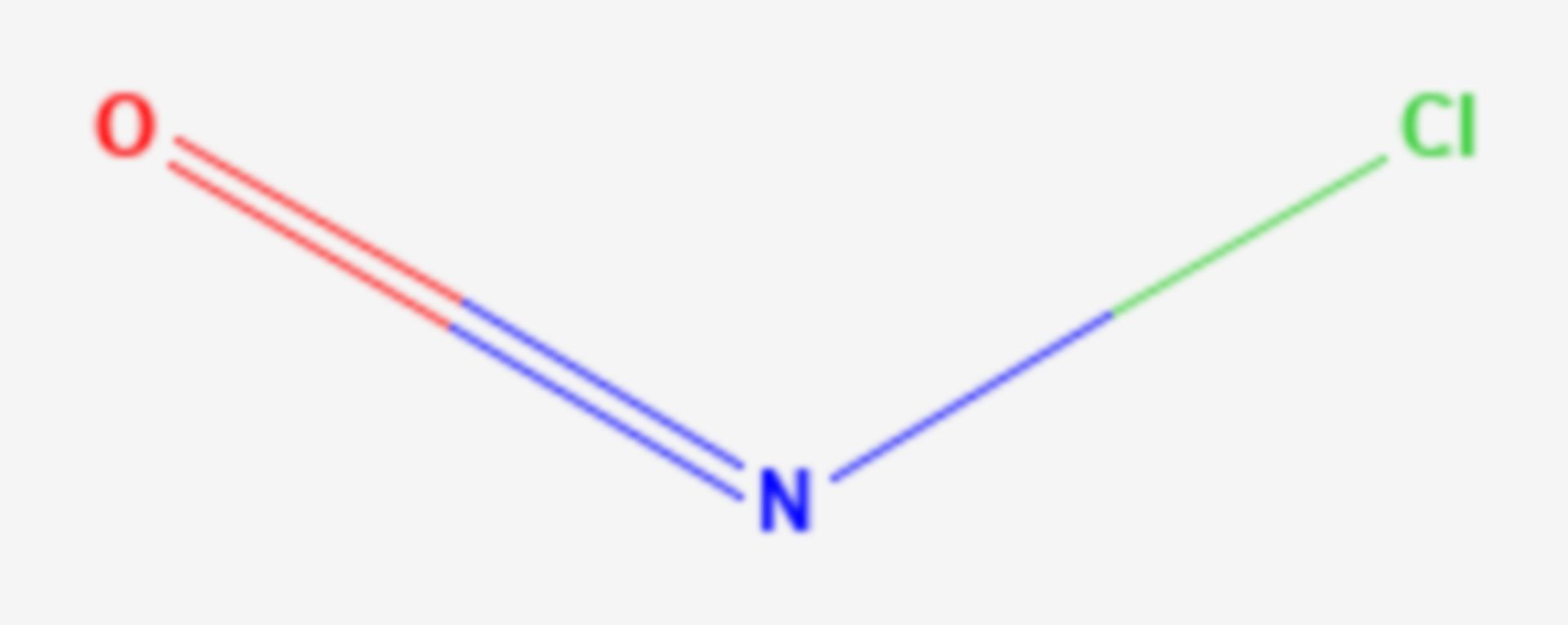
Il cloruro di nitrosile è un composto inorganico di formula NOCl o anche Cl–N=O. Esso è un gas giallognolo tossico. Costituisce parte dei fumi che fuoriescono da soluzioni di acqua regia.
Sintesi
Il cloruro di nitrosile viene prodotto su scala industriale per reazione fra acido cloridrico ed acido nitrosilsolforico.
Un altro metodo di produzione del cloruro di nitrosile è far reagire direttamente i suoi elementi costituenti a circa 400 °C.
Un metodo facilmente applicabile in laboratorio è la disidratazione dell'acido nitroso tramite HCl.
Michael Faraday preparò NOCl per reazione tra palladio ed acqua regia.
Il cloruro di nitrosile viene prodotto per lenta reazione fra l'acido nitrico e l'acido cloridrico che compongono l'acqua regia.
HNO3 3 HCl -> Cl2 2 H2O NOCl
Questa reazione venne studiata da Edmund Davy nel 1831.
Tuttavia in presenza di acido nitrico NOCl si ossida istantaneamente in diossido di azoto, fornendo all'acqua regia il caratteristico colore aranciato.
Reazioni
Il cloruro di nitrosile è un elettrofilo e reagisce con gli epossidi per dare α-cloronitriti di alchile:
Reagisce inoltre con i cheteni per dare nitrosil-derivati e con le ammine cicliche per dare alcheni.
Impieghi
Il cloruro di nitrosile reagisce fotochimicamente con il cicloesano per dare il cloridrato di cicloesanonossima, precursore del caprolattame, a sua volta usato per produrre il nylon-6.
Note
Voci correlate
- Monossido di azoto
- Cloruro di cianogeno
- Tricloruro di azoto
Altri progetti
- Wikimedia Commons contiene immagini o altri file su cloruro di nitrosile